Indica vs. Sativa: Entendiendo las diferencias

El cannabis es uno de los cultivos más antiguos conocidos por la humanidad, con lo que los registros de su cultivo se remontan a miles de años.
Hoy en día es ampliamente aceptado que el cannabis tiene dos especies diferentes: Cannabis indica y Cannabis sativa. El cruce de los dos tipos ha conducido a una amplia variedad de cepas híbridas con características únicas.
Sin embargo, las diferencias reales entre Cannabis Indica y Cannabis sativa siguen siendo un tema de mucho debate.
Apariencia
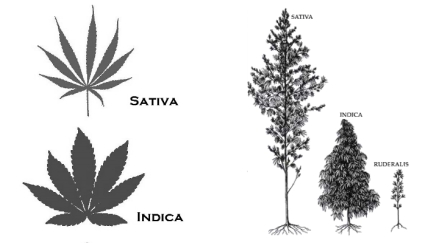
La forma más aceptada de distinguir indica vs sativa es por la apariencia, o lo que los científicos se refieren como la morfología.
Las plantas sativa son altas, ligeramente ramificada y tienen hojas largas y estrechas. Por lo general, se cultivan al aire libre y pueden alcanzar alturas de hasta 6 metros.
Las plantas índicas son cortas, densamente ramificadas y tiene hojas más anchas. Éstas son más adecuadas para el cultivo en interior.
Efectos
Además de la apariencia, las plantas índica y sativa se cree comúnmente para tener diferentes efectos en su usuario.
Estos efectos incluyen:
Sativa
- inspiradora y enérgica
- cerebral, ausente o alucinógena
- más adecuado para el uso diario
Indica
- relajante y calmante
- tranquilizante, sedante
- más adecuado para el uso nocturno
Sin embargo, ningún estudio científico ha confirmado estas diferencias, y hay algunas dudas acerca de su exactitud. De hecho, la historia sugiere una diferencia mucho más simple entre indica y sativa.
La clasificación original de Cannabis indica fue hecha por el biólogo francés Jean-Baptiste Lamarck en 1785. Lamarck observó que ciertas plantas de marihuana procedentes de la India eran intoxicantes y podría convertirse en el hachís. Pero los cultivos de cáñamo tradicionales, que eran más comunes en Europa, no tuvieron un efecto que alterara la mente.
Se le ocurrió el nombre de Cannabis indica para distinguir el cannabis indio del cáñamo Europeo, que era conocido en ese entonces como Cannabis sativa. Del mismo modo, Cannabis indica fue reconocida específicamente como agente terapéutico en la medicina occidental durante la década de 1800.
Origen / Genética
Los científicos que han estudiado las diferencias entre indica y sativa han llegado con una serie de teorías basadas en la genética. Una teoría predominante se centra en la producción genética de THC y CBD.
Las plantas que producen altos niveles de THC expresan genes que codifican para la enzima sintasa THCA. Esta enzima convierte CBG en THCA, que se convierte en THC cuando se calienta. Estas plantas se consideran típicamente indicas.
Por otro lado, algunas plantas expresan genes que codifican para la enzima CBDA sintasa. Esta enzima convierte CBG en CBDA, el precursor de la CDB, en su lugar. Estas plantas se consideran típicamente sativa.
Sobre la base de esta explicación, las plantas índicas tienen un alto THC: CBD ratio y plantas sativa tienen un alto CBD:THC de ratio.
El problema es que, hoy en día, muchas cepas producen cantidades variables de ambas enzimas. Algunos investigadores creen que esto se debe a la hibridación de los bancos de genes, lo que explica por qué algunas sativas son ricas en THC y algunos índicas no lo son.
Fuente: Leaf Science
Las variedades de cannabis ricas en CBD difieren en efectos farmacológicos de las ricas en THC
Investigaciones realizadas con 102 pacientes de los Países Bajos, que consumieron tres diferentes variedades de cannabis de las farmacias con fines medicinales, muestran que los efectos farmacológicos difieren dependiendo de la proporción de THC y CBD. Estos estudios han sido realizados por el Instituto Holandés de Salud Mental y Adicciones de Utrecht y la Oficina de Cannabis Medicinal del Ministerio de Sanidad holandés, y fueron publicados en el Journal of Psychopharmacology. El 47% de los enfermos consumía la variedad Bedrocan con un 19% de THC y menos del 1% de CDB, el 28’5% la variedad Bedrobinol con un 12% de THC y menos del 1% de CDB, y el 24’5% Bediol con cantidades casi iguales de THC (6%) y CBD (7’5%). El análisis estadístico de los efectos subjetivos reveló que el alto contenido de THC en las variedades Bedrocan y Bedrobinol dió lugar a un aumento del apetito en comparación con la Bediol. Hubo también un mayor nivel de ansiedad y depresión en el grupo que consumió Bedrocan en comparación con el tomó Bediol.
La indicación médica más común para el consumo de cannabis fue el dolor crónico (53%), seguido por la esclerosis múltiple (23%), y el 86% de los pacientes experimentaron satisfacción terapéutica independientemente de variedad de cannabis utilizada. Los autores del estudio dicen que «estos resultados muestran que los enfermos refieren satisfacción terapéutica con el cannabis farmacéutico, principalmente el alivio del dolor». La cantidad de cannabis utilizado no fue diferente entre las diferentes cepas. Con respecto a los diferentes efectos los autores sugieren que «el CBD puede tener un efecto modulador sobre algunos de los efectos adversos subjetivos conocidos del THC, como la ansiedad y el estado de ánimo deprimido».
Fuente: IACM
Los inspectores de hacienda plantean legalizar la prostitución y el tráfico de drogas blandas para recaudar 6.000 millones en nuevos impuestos
LOS INSPECTORES PLANTEAN QUE LA PROSTITUCIÓN MUEVE 18.000 MILLONES DE EUROS AL AÑO QUE PODRÍAN REPORTAR 6.000 MILLONES EN IMPUESTOS AL ESTADO Y ENGROSAR LAS ARCAS DE LA SEGURIDAD SOCIAL. IGUALMENTE, PLANTEAN GRAVAR EL TRÁFICO DE DROGAS BLANDAS. ADEMÁS, LOS INSPECTORES PIDEN CAMPAÑAS DE PUBLICIDAD PARA CONCIENCIAR CONTRA EL FRAUDE FISCAL.
18.000 millones de euros mueve al año la prostitución en España, según la estimación de los inspectores de Hacienda, que han planteado que si esa actividad fuera legalizada y tributara a un tipo del 30% podría reportar a las arcas públicas hasta 6.000 millones de euros. Igualmente, el tráfico de drogas como la marihuana o el cannabis podrían reportar miles de millones de euros en impuestos al Estado, calcula la Organización de Inspectores Fiscales (IHE) que han remitido al Gobierno un informe en el que piden que se abra el debate sobre la legalización de la prostitución o el tráfico de drogas blandas. Para ello, han pedido al Gobierno que cuantifique efectivamente las cifras de ese tráfico de drogas.
«Proponemos la apertura de un debate para que determinadas actividades ilegales puedan considerarse como legales y que, por tanto, tributen pese a estar despenalizadas. Hablamos de la prostitución o el tráfico de drogas blandas que merecen un reproche moral pero no fiscal», ha asegurado Ramsés Pérez Boga que ha argumentado que «esa legalización tendría un efecto más ya que las personas que trabajan en esos sectores engrosarían las arcas de Seguridad Social y entrarían dentro del circuito del Estado del bienestar». La legalización de este tipo de actividades permitirían controlar más esos sectores y eliminar delitos como la coacción o los delitos de proxenetismo, defienden los Inspectores de Hacienda.
«Hay mucha moralina y muy poco debate serio sobre cuestiones como la fiscalidad de la prostitución o el cannabis», ha concluido Domingo Carbajo, quien ha colaborado a elaborar el informe remitido al ministro Cristóbal Montoro.
Censo de morosos con Hacienda
Los inspectores plantean, además, crear un censo de morosos público para quienes tengan una deuda con Hacienda y para quien han pasado los plazos de pago, embargo y demás. Sería un censo público para dejar constancia de quién no paga los impuestos que –según la inspección– serviría para detectar quién va a dejar de pagar a sus proveedores porque «quien tiene impagos con Hacienda acaba teniendo también impagos con sus proveedores», concluye el informe.
La medida planteada por los inspectores llega después de una amnistía fiscal a la que responsabilizan de la caída de la recaudación. “Es imprescindible una concienciación fiscal después de una amnistía que ha hecho un daño terrible que explica en parte la caída de recaudación”, aseguran, antes de pedir al Ejecutivo que se emitan campañas publicitarias a la población para que expliquen cómo el fraude fiscal puede drenar recursos en sanidad o educación. Entre los ejemplos planteados, se ha señalado cómo quien truca su declaración de la renta puede desplazar a una persona más necesitada en la asignación de plazas escolares. «Es necesario educar», ha concluido Pérez Boga.
Los inspectores de Hacienda han defendido una «reforma integral» del sistema fiscal atacando especialmente el fraude fiscal, entendido tanto como la elusión como el impago de impuestos. Así, los inspectores proponen modificaciones para combatir:
- Defraudación fiscal: Plantean la «redimensión de plantilla de la Agencia Tributaria, aumentando los medios humanos y materiales al nivel de los países de nuestro entorno e importancia».
- Elusión tributaria: Enfocada especialmente hacia las grandes multinacionales como las grandes empresas españolas
- Afloración de la economía sumergida: Legalizando, por ejemplo, prostitución y tráfico de drogas blandas para aumentar la recaudación
- El impago de deudas tributarias: Según los inspectores, entre 12.000 y 14.000 millones de años se pierden anualmente en las cuentas públicas como deudas que Hacienda reclama a los defraudadores pero que esos defraudadores nunca pagan
Recentralizar impuestos desde las autonomías
Un proceso «recentralizador» en materia de impuestos. Es una de las propuestas centrales de los Inspectores de Hacienda ante la futura reforma fiscal que el Ejecutivo presentará entre esta semana y la que viene. En un documento que la Organización de Inspectores de Hacienda (IHE) ha remitido al Gobierno se plantea que «el Estado no ceda más competencias fiscales y que se recupere la gestión de los impuestos cedidos por su conexión con el IRPF».
Los inspectores plantean que todas las comunidades autónomas deberán adherirse a un sistema informático centralizado y único en Hacienda que –según su propuesta– «permitiría dentro de la soberanía propia de cada administración, gestionar el sistema tributario con una cierta unidad de mercado garantizada por esta red. «Sería lo más eficiente y lo más lógico», ha asegurado el Presidente de IHE, Ramsés Pérez Boga.
Entre las propuestas para homogeneizar tributos, los inspectores piden también crear una ventanilla única incluso en las administraciones forales «de tal manera que no tengan que presentar las empresas una declaración a cada administración». En ese proceso recentralizador, el informe remitido al Ejecutivo pide armonizar procedimientos com los de valoraciones inmobiliarias para que en toda España se apliquen los mismos criterios de recaudación y se puedan aplicar los mismos procedimientos de inspección coordinadas.
Fuente: Cannabis Magazine
El Sistema Endocannabinoide como nueva diana terapéutica
MANUEL GUZMÁN
Catedrático del Departamento de Bioquímica y Biología Molecular, Facultad de Ciencias Químicas, Universidad Complutense de Madrid

La marihuana (Cannabis sativa L.) se ha empleado tanto médica como recreativamente desde hace muchos siglos. Hoy en día sabemos que sus componentes activos (los cannabinoides) actúan en el organismo a través de receptores específicos (los receptores cannabinoides) que son activados normalmente por moléculas endógenas (los endocannabinoides) y regulan críticamente la neurotransmisión en numerosas regiones del sistema nervioso central. Estos hallazgos han contribuido a un renacimiento del estudio de las posibles aplicaciones terapéuticas de los cannabinoides, lo que constituye hoy día un tema de amplio debate científico, clínico y social.Cannabinoides y endocannabinoides
La marihuana (Cannabis sativa L.) es la droga ilegal más ampliamente consumida en Occidente. Químicamente hablando se trata de la única especie del Reino Vegetal que, por lo que hoy en día sabemos, produce “cannabinoides”, una familia de moléculas de la cual ya conocemos casi un centenar de representantes diferentes. Aunque no se han estudiado con detalle las propiedades farmacológicas de la mayoría de estos compuestos, está ampliamente aceptado que el D9-tetrahidrocannabinol (THC) es el más importante debido tanto a su alta abundancia en la planta como a su elevada potencia de acción. Otros cannabinoides, como el cannabinol y el cannabidiol, pueden aparecer así mismo en niveles significativos en la planta y sus preparados, pero su potencia de acción es claramente más reducida que la del THC.
Desde hace aproximadamente 20 años sabemos que el THC ejerce una gran variedad de efectos, tanto en el sistema nervioso central como en distintas localizaciones periféricas, debido a que es similar a una familia de moléculas producidas por nuestro organismo y cuya acción por tanto mimetiza. Estas moléculas se denominan por ello “cannabinoides endógenos” o “endocannabinoides”, y, químicamente hablando, se trata de una familia más de derivados bioactivos del ácido araquidónico, el cual se emplea como precursor para la generación de un gran número de mensajeros químicos en nuestro organismo. En concreto, los endocannabinoides comprenden dos compuestos de naturaleza eicosanoide: por un lado, la N-araquidoniletanolamina (AEA), esto es, la amida del ácido araquidónico y la etanolamina (generalmente conocida como “anandamida”, con el sufijo “amida”, que denota el enlace químico característico de la molécula, y el prefijo sánscrito “ananda”, que significa “embeleso” o “placer interno”, en alusión a los efectos que produce ingerir marihuana). Por otro lado, el 2-araquidonilglicerol (2-AG), esto es, el éster del ácido araquidónico y el grupo hidroxilo en posición sn-2 del glicerol.
Receptores cannabinoides
Los cannabinoides de C. sativa actúan pues en el organismo a través de las mismas dianas moleculares que los cannabinoides endógenos. Se trata de receptores específicos localizados en la membrana plasmática de nuestras células y que se denominan “receptores cannabinoides” (abreviadamente receptores CB), de los cuales existen hoy en día dos tipos bien caracterizados molecular y funcionalmente hablando: el receptor cannabinoide de tipo 1, o receptor CB1, y el receptor cannabinoide de tipo 2, o receptor CB2. Es posible no obstante que existan en el organismo otros receptores, como algunos receptores acoplados a proteínas G aún huérfanos (por ejemplo, GPR55) o algunos canales iónicos (por ejemplo, TRPV1), que medien algunas de las acciones de los (endo)cannabinoides.
Los receptores cannabinoides pertenecen a la principal superfamilia de receptores del organismo, los receptores acoplados a proteínas G, y señalizan principalmente a través de proteínas Gi. Así, los receptores cannabinoides modulan rutas de señalización intracelular de gran importancia como la clásica vía de la adenilil ciclasa-cAMP-proteína quinasa A y, como veremos más adelante, afectan también a la conductancia de algunos canales de Ca2+ y K+. Además, nuestro grupo ha contribuido a caracterizar el acoplamiento de los receptores CB1 y CB2 a otras rutas de comunicación intracelular como la vía de la fosfatidilinositol 3-quinasa/Akt, la cascada de proteína quinasas activadas por mitógenos ERK (quinasa regulada por señales extracelulares;extracellular signal-regulated kinase), las cascadas de proteína quinasas activadas por estrés JNK (quinasa del extremo N-terminal de c-Jun, c-Jun N-terminal kinase) y p38, y la generación del mediador esfingolipídico ceramida. Éstos y otros mecanismos participan en el control de muy diversas funciones celulares por los receptores cannabinoides.
Como parece lógico suponer, únicamente los tejidos del organismo que poseen receptores específicos para cannabinoides son blanco de la acción de estos compuestos. En concreto, la mayor parte de los efectos de los cannabinoides están mediados por el receptor CB1, inicialmente denominado “receptor central de cannabinoides” por su localización mayoritariamente cerebral pero que hoy en día sabemos posee una localización muy ubicua. Este receptor es especialmente abundante en áreas del sistema nervioso central implicadas en el control de la actividad motora (ganglios basales, cerebelo), memoria y aprendizaje (corteza, hipocampo), emociones (amígdala), percepción sensorial (tálamo) y diversas funciones autónomas y endocrinas (hipotálamo, médula), lo que lógicamente explica que los endocannabinoides modulen estos procesos y que el consumo de marihuana interfiera con ellos. El receptor CB1 está también presente, por ejemplo, en las terminales nerviosas periféricas que inervan tanto la piel como el tracto digestivo, circulatorio y respiratorio, así como en numerosos tejidos y órganos como el endotelio vascular, hueso, testículos, útero, ojos, hígado y tejido adiposo.
El receptor CB2, inicialmente denominado “receptor periférico de cannabinoides” frente al “receptor central de cannabinoides” (CB1), muestra una distribución más restringida que el receptor CB1, y está fundamentalmente presente en el sistema inmune, tanto en células periféricas (por ejemplo, linfocitos y monocitos/macrófagos) como en tejidos (por ejemplo, bazo y ganglios linfáticos). Así, este receptor está implicado en la modulación de la respuesta inmune por los (endo)cannabinoides.
Sistema endocannabinoide
Los endocannabinoides, junto con sus receptores y sistemas específicos de síntesis y degradación, constituyen en el organismo el denominado “sistema cannabinoide endógeno” o “sistema endocannabinoide”. Este sistema (o al menos parte de sus componentes) aparece de forma altamente conservada en la gran mayoría de animales, al menos en todos los deuteróstomos, y su función hasta ahora mejor establecida es la de constituir un mecanismo de neuromodulación retrógrada en el sistema nervioso central. Así, cuando se sobreactivan diversos receptores de neurotransmisores en la membrana plasmática de una neurona postsináptica, ésta sintetiza precursores de endocannabinoides y los escinde para liberar a la hendidura sináptica endocannabinoides funcionalmente activos. Esto acontece, por ejemplo, tras la unión de algunos neurotransmisores como el glutamato a sus receptores ionotrópicos o metabotrópicos, con la consiguiente elevación de la concentración citoplasmática de Ca2+. Los endocannabinoides actúan entonces como mensajeros químicos retrógrados, esto es, se unen a receptores CB1 de la neurona presináptica, lo que induce por ejemplo que se dificulte la entrada en ella de iones Ca2+(por el cierre de canales de Ca2+ sensibles a potencial) y se facilite la salida de iones K+ (por la apertura de canales rectificadores de K+ sensibles a proteínas G). Ello dificulta la despolarización de la membrana plasmática e inhibe los procesos de exocitosis. De esta manera se bloquea la liberación del neurotransmisor correspondiente (como el glutamato en este ejemplo).
La acción neuromoduladora de los endocannabinoides, al igual que la de muchos otros neurotransmisores y neuromoduladores, finaliza mediante su recaptura celular a través de un sistema de transporte de membrana plasmática y su posterior degradación intracelular, que corre a cargo de una familia de lipasas entre las cuales la hidrolasa de amidas de ácidos grasos (fatty acid amide hydrolase, FAAH) y la monoacilglicerol lipasa (MAGL) son las mejor caracterizadas para la rotura de la AEA y el 2-AG, respectivamente.
El receptor CB1 cannabinoide es en general uno de los tipos de receptores más altamente expresados en el sistema nervioso central y, en concreto, es el receptor presináptico acoplado a proteínas G más abundante en el cerebro adulto de los mamíferos hasta ahora estudiados, hallándose presente, como hemos mencionado, en prácticamente todas las regiones de este órgano. La localización presináptica del receptor CB1fue mostrada por vez primera en terminales axonales de interneuronas hipocampales, y hoy en día se conocen numerosos ejemplos de otras neuronas GABAérgicas (por ejemplo, corticales y estriatales), así como glutamatérgicas (por ejemplo, corticales, hipocampales, hipotalámicas y cerebelares) o de vías subcorticales ascendentes (por ejemplo, terminales colinérgicas, noradrenérgicas y serotoninérgicas), que expresan altas cantidades de receptores CB1 presinápticos. Además de esta localización característica en terminales presinápticas, se ha descrito la existencia de receptores CB1 en algunas neuronas postsinápticas, cuya activación inhibe los canales de Ca2+ sensibles a potencial y los receptores ionotrópicos de glutamato de tipo N-metil-D-aspartato. Los receptores CB1 del sistema nervioso central también se expresan en astrocitos, donde podrían controlar el aporte trófico de estas células a las neuronas y los procesos de comunicación sináptica entre ambos tipos de células, así como en oligodendrocitos y en células del endotelio vascular. Por último, el receptor CB2 cannabinoide se expresa en células de microglía, los macrófagos residentes del tejido nervioso, donde inhibe la activación de dichas células y produce por tanto un descenso en la liberación de citoquinas proinflamatorias y especies reactivas de oxígeno y nitrógeno, lo que conlleva a su vez una atenuación de los procesos neuroinflamatorios. Todos estos efectos complementan la acción de mensajeros retrógrados que ejercen los endocannabinoides sobre la plasticidad sináptica y la funcionalidad neuronal.
Por último, es importante mencionar que el sistema endocannabinoide no sólo se expresa en el sistema nervioso adulto, sino que, como ha demostrado nuestro grupo y otros laboratorios, también lo hace en el cerebro en desarrollo, en el cual evidencia un patrón de distribución “atípico”, ya que, por ejemplo, durante etapas prenatales el receptor CB1 abunda en células progenitoras neurales y en proyecciones axonales que conforman áreas de sustancia blanca. Los estudios más recientes sugieren que, durante el desarrollo cerebral, el sistema endocannabinoide controla procesos esenciales como la proliferación, migración, diferenciación y supervivencia de células neurales, así como la elongación y fasciculación de axones y la formación de conexiones sinápticas durante el establecimiento de los patrones morfogenéticos del sistema nervioso.
Posibles aplicaciones terapéuticas de los cannabinoides
La marihuana y sus preparados se han empleado en Medicina desde hace al menos 50 siglos. Los descubrimientos recientes en el conocimiento del sistema endocannabinoide resumidos anteriormente han contribuido al renacimiento del estudio de las posibles aplicaciones terapéuticas de los cannabinoides, lo que constituye hoy en día un campo de amplio debate científico, clínico y social. Basándose en la demostración de la función moduladora que los endocannabinoides ejercen sobre numerosas funciones cerebrales, se ha sugerido el potencial terapéutico que la manipulación farmacológica de sus niveles o la administración de agonistas cannabinoides (bien cannabinoides de la planta, bien cannabinoides sintéticos) podría tener en el tratamiento de diversas patologías que afectan al sistema nervioso. En algunas de estas enfermedades ya se ha podido poner de manifiesto que existen cambios en la expresión de receptores cannabinoides y/o en los niveles de endocannabinoides en ciertas zonas del cerebro, lo que justificaría el estudio farmacológico de este sistema. Por ejemplo, y de forma general, los cannabinoides ejercen efectos analgésicos que los harían de utilidad en el tratamiento del dolor. También podrían ser útiles en el tratamiento de los procesos de neuroinflamación, en los que su administración permitiría paliar algunas consecuencias típicas de dichos desórdenes. Hoy en día sabemos además que, bajo determinadas ventanas terapéuticas, los cannabinoides son capaces de proteger a las neuronas frente a diversas situaciones de daño, lo que podría tener interés para el tratamiento de episodios de daño cerebral agudo y quizás de enfermedades neurodegenerativas. Su participación en los procesos de memoria hace pensar que los cannabinoides podrían ser de utilidad en trastornos como la extinción de memorias aversivas en situaciones de estrés post-traumático. Análogamente, la presencia de receptores cannabinoides en regiones del sistema límbico y el hipotálamo anterior permitiría que la manipulación de dichos receptores pudiera ser una aproximación farmacológicamente relevante en el tratamiento detrastornos alimentarios y metabólicos, así como de fenómenos compulsivos relacionados con laadicción a drogas.
A pesar de todo ello, la utilización clínica de los cannabinoides y otros compuestos que afectan a la señalización cannabinérgica es hoy en día bastante restringida. En la actualidad se permite en algunos países la prescripción de cápsulas de THC (Marinol) y del cannabinoide sintético nabilona (Cesamet), así como la dispensa de preparaciones estandarizadas de marihuana medicinal, para inhibir la nausea y el vómito, estimular el apetito y atenuar la caquexia en pacientes de cáncer o sida. Recientemente se ha aprobado un nuevo medicamento cannabinoide, el Sativex, un aerosol oro-mucosal compuesto por extractos de cannabis ricos en THC y cannabidiol, para el tratamiento del dolor oncológico y neuropático (hasta ahora solo en Canadá) y de la espasticidad asociada a la esclerosis múltiple (en varios países, incluida España). Existen además otras posibilidades terapéuticas de los cannabinoides que se hallan aún en diversas fases de ensayos clínicos.
Los cannabinoides son sustancias bastante seguras en el contexto de su aplicación clínica, pero su uso médico está en parte dificultado por sus efectos psicoactivos no deseados, entre los que se incluyen los de tipo afectivo (euforia), somático (somnolencia, descoordinación motora), sensorial (alteraciones en la percepción temporal y espacial, desorientación) y cognitivo (lapsos de memoria, confusión). Aunque dichos efectos secundarios puedan ser transitorios y estar dentro de los márgenes aceptados para otros medicamentos, está claro que, al menos para determinados pacientes y enfermedades, sería deseable diseñar cannabinoides que carecieran de acciones psicotrópicas. Puesto que éstas dependen de los receptores CB1 centrales, la opción más lógica sería evitar la activación de dichos receptores (siempre que la patología en cuestión lo haga viable). Así, por ejemplo, se están diseñando cannabinoides que se unen selectivamente al receptor CB2 y cannabinoides que no atraviesan la barrera hematoencefálica y por tanto no alcanzan el sistema nervioso central. Por otro lado, la administración a animales de experimentación de inhibidores de la degradación (recaptura o hidrólisis intracelular) de endocannabinoides ha permitido conseguir la elevación de los niveles de estos compuestos en contextos espacio-temporales restringidos y, de esta manera, la inducción de efectos por ejemplo bradiquinésicos, ansiolíticos o analgésicos sin efectos secundarios notorios. Este tipo de compuestos todavía no ha sido, sin embargo, objeto de ensayos clínicos exitosos.
En este contexto del conocimiento general del campo, nuestro grupo de investigación comenzó a estudiar hace ya unos 15 años los mecanismos moleculares por los cuales los cannabinoides, tanto los endógenos como los de la planta, actúan en el organismo. Más concretamente, nuestro interés se centró en dilucidar si estos compuestos son capaces de alterar algunos procesos centrales de la biología celular como la proliferación, diferenciación y supervivencia, sobre todo (aunque no exclusivamente) en el sistema nervioso. La comprensión de estos eventos es esencial para el conocimiento preciso de procesos biológicos como el desarrollo del sistema nervioso, así como para la caracterización de la etiología y progresión de las enfermedades neurodegenerativas (caracterizadas por la disfunción y pérdida de células nerviosas) y de los procesos oncológicos (caracterizados por una proliferación y supervivencia celulares desmesuradas) y, por tanto, para el diseño de terapias racionales para su tratamiento. Estos tres paradigmas concretos constituyen la base de los principales proyectos de investigación que nuestro grupo lleva a cabo hoy en día. Por ejemplo, y de forma muy resumida, a lo largo de este tiempo hemos observado que, tras unirse a sus receptores, los cannabinoides modulan numerosas vías de señalización intracelular en distintos tipos de células neurales, lo cual se traduce en efectos tales como la estimulación de la proliferación de células progenitoras neurales para generar neuronas y células de neuroglía, la protección y supervivencia de neuronas y células de neuroglía, la inactivación de células de microglía y la inducción de muerte programada en células tumorales de origen glial (glioma). Estos acontecimientos celulares tienen una clara relevancia fisiológica en animales de laboratorio, en los cuales se observa cómo los cannabinoides, por ejemplo, controlan el desarrollo de la corteza cerebral, contribuyen a la regeneración y protección del tejido nervioso en situaciones de daño, e inhiben el crecimiento de tumores malignos.
La comunidad científica se encuentra hoy en día en un punto en el cual se ha acumulado un conocimiento relativamente bueno de cómo actúan molecularmente los cannabinoides en el organismo y de cuáles pueden ser algunas de sus aplicaciones terapéuticas más inmediatas. Sin embargo, es necesario llevar a cabo investigación básica más profunda y ensayos clínicos más exhaustivos para comprender más sólidamente la función biológica y el potencial terapéutico de estos nuevos mensajeros químicos de nuestro organismo.
Fuente: THC Terapéutico


Comentarios recientes